Для кого: широкая аудитория (ЗОЖ-ориентированные читатели), врачи, нутрициологи
Тип доказательств: метаанализы, РКИ, публикации PubMed
Дадали Чат
Консультации по нутрициологии на базе знаний профессора Дадали
Получите научно-обоснованные рекомендации в чате, где работают как живые специалисты, так
и интеллектуальный бот, обученный на лекциях профессора Владимира Абдулаевича Дадали
Главное из статьи за 30 секунд
- Оксидативный (окислительный) стресс – это дисбаланс между образованием активных форм кислорода (АФК) и способностью антиоксидантной системы нейтрализовать их. В норме АФК участвуют в работе иммунитета и сигнальных процессах, но при избытке вызывают цепную реакцию повреждения клеток.
- Свободные радикалы (тип АФК) обладают неспаренным электроном и очень высокой реактивностью. Они запускают перекисное окисление липидов мембран, окислительную модификацию белков и повреждение ДНК. В результате нарушается работа клеток, что может лежать в основе старения и многих заболеваний.
- Причины окислительного стресса разнообразны. Внутри организма АФК образуются в митохондриях при дыхании, работе ферментов (NADPH-оксидаза, ксантиноксидаза и др.) и при воспалении. Внешние факторы – курение, ультрафиолет и радиация, загрязнение воздуха, токсины, хронический стресс, неправильное питание с дефицитом антиоксидантов – увеличивают образование свободных радикалов.
- Чем опасен окислительный стресс: Избыток АФК приводит к повреждению сосудов и нервных клеток, ускоряет старение и повышает риск болезней. Оксидативный стресс признан одним из ключевых факторов в развитии сердечно-сосудистых патологий (атеросклероза, гипертонии), нейродегенеративных заболеваний (болезней Альцгеймера, Паркинсона), диабета, остеопороза и рака.
- Антиоксидантная защита – это многоуровневая система нашего организма, включающая ферменты (супероксиддисмутаза, каталаза, глутатионпероксидаза и др.), высокомолекулярные белки и низкомолекулярные соединения (глутатион, витамины C, E, каротиноиды, коэнзим Q10 и др.). Антиоксиданты работают синергично, каждый нейтрализует определенные радикалы в своей среде, поэтому они не взаимозаменяемы.
- Как снизить окислительный стресс: Комплексный подход – сбалансированное питание с обилием овощей, фруктов, отказ от курения и лишнего алкоголя, умеренные физические нагрузки, управление стрессом и достаточный сон – помогает уменьшить образование АФК и укрепить внутреннюю антиоксидантную систему. Применение антиоксидантных добавок возможно и полезно при дефицитном питании по назначению специалиста, но они должны быть качественными: избыток синтетических витаминов способен нарушить баланс и даже повысить риски для здоровья.
Что такое окислительный стресс простыми словами
Окислительный стресс – это патологическое состояние, при котором в организме накапливаются продукты свободно-радикального окисления из-за дисбаланса между образованием активных форм кислорода и активностью антиоксидантной системы. Проще говоря, это ситуация, когда свободных радикалов становится слишком много, и защитные механизмы клеток не успевают их обезвредить. В норме такие реактивные молекулы образуются каждую секунду в процессе дыхания и обмена веществ, а антиоксиданты сразу их нейтрализуют. Но если баланс смещается в сторону окисления, агрессивные окислители начинают бесконтрольно повреждать ткани.
Окислительный стресс можно представить как своеобразную «ржавчину» внутри клеток. Когда молекулы кислорода превращаются в высокореактивные формы (например, радикалы), они стремятся отнять электрон у других молекул, чтобы стабилизироваться. Этот процесс запускает цепную реакцию окисления: пострадать могут липиды клеточных мембран, белки и даже ДНК. Особенно чувствительны к такой атаке мембраны, богатые ненасыщенными жирными кислотами – их перекисное окисление ведет к потере целостности клеток.
Цепной механизм перекисного окисления липидов: свободнорадикальная реакция запускается, когда гидроксильный радикал (•OH) отнимает атом водорода у ненасыщенной жирной кислоты мембраны, образуя радикал липида (L•). Затем радикал липида присоединяет кислород, превращаясь в пероксильный радикал (LOO•), который в свою очередь отнимает водород у другой молекулы липида. Так возникает цепная реакция: формируются новые липидные радикалы и липидные гидроперекиси (LOOH). Этот процесс будет продолжаться, пока не истощатся либо радикалы, либо антиоксиданты (например, витамин E способен разорвать цепь, отдав электрон радикалу).
Важно понимать, что сами активные формы кислорода (АФК) существуют очень недолго и не «накапливаются» в организме, как часто говорят – опасны именно их эффекты. Термин «окислительный стресс» ввёл в научный обиход Хельмут Зис в 1985 году, описав это состояние как нарушение равновесия между про- и антиоксидантами. В норме небольшое количество АФК даже необходимо: они участвуют в передаче сигналов, иммунной защите (например, уничтожая бактерии) и регуляции запрограммированной гибели поврежденных клеток (апоптоза). Поэтому нельзя считать все свободные радикалы абсолютным злом – опасен их избыток и дисбаланс.
Свободные радикалы и их роль в повреждении клеток
Свободные радикалы – это молекулы или атомы, у которых на внешней электронной оболочке имеется неспаренный электрон. Такое состояние крайне неустойчиво, поэтому радикал «агрессивно» ищет, у кого бы этот электрон забрать. В организме человека основными свободными радикалами являются активные формы кислорода: супероксидный анион O₂•⁻, гидроксильный радикал •OH, пероксильные радикалы ROO• и др. К АФК также относят некоторые нерадикальные, но очень реактивные соединения, например перекись водорода H₂O₂ и пероксинитрит ONOO⁻.
Когда свободный радикал отнимает электрон у нормальной молекулы, сам он стабилизируется, а «жертва» превращается в новый радикал. Так стартует каскад повреждений. Например, гидроксильный радикал •OH способен атаковать фосфолипид мембраны, инициируя цепь перекисного окисления липидов (ПОЛ). В ходе ПОЛ образуются липидные радикалы и липидные перекиси, которые нарушают структуру мембран, повышая их проницаемость. Клетка теряет важные ионы и микроэлементы, изменяется pH внутриклеточной среды, что нарушает работу ферментов. Одновременно продуцируются токсичные альдегиды (например, малоновый диальдегид – МДА), которые сами по себе способны повреждать белки и ДНК.
Кроме мембран, свободные радикалы поражают:
- ДНК: Радикалы (особенно •OH) вызывают разрывы цепей ДНК и модификации оснований (например, образование 8-оксо-2’-дезоксигуанозина). Это ведёт к мутациянным изменениям генома. Если повреждение происходит в генах, контролирующих деление клеток, появляется риск развития опухолей.
- Белки: Окисление аминокислотных остатков приводит к денатурации белков – они теряют структуру и функцию. Кроме того, при избытке АФК усиливается неферментативное гликирование белков (присоединение сахаров), что характерно для сахарного диабета и ведёт к нарушению функций ферментов, рецепторов и коллагена.
- Углеводы и другие молекулы: Радикалы могут изменять почти все компоненты клетки, запускают перекисное окисление холестерина, что способствует образованию атеросклеротических бляшек, и нарушают регуляцию простагландинов, влияя на тонус сосудов.
Таким образом, свободные радикалы действуют как «снаряды», пробивающие клеточные структуры. Чем дольше сохраняется дисбаланс, тем больше кумулятивный урон для тканей. Многие проявления старения – морщины, потеря упругости кожи, снижение мышечной силы – во многом связаны с хроническим оксидативным стрессом. Тело как будто «изнашивается» под постоянными микроскопическими атаками. Неудивительно, что ученые связывают повышенный уровень АФК с более высоким риском хронических заболеваний и сокращением продолжительности жизни.
Механизмы развития и причины окислительного стресса
Почему возникает дисбаланс между окислителями и антиоксидантами? Причины окислительного стресса можно условно разделить на две группы: чрезмерное образование активных форм кислорода и ослабление антиоксидантной защиты. Чаще эти факторы действуют совместно.
Эндогенные механизмы повышения АФК (внутренние источники):
- Дыхательная цепь митохондрий. До 95–98% вдыхаемого кислорода клетки успешно используют для синтеза АТФ, однако ~2–5% кислорода превращается в супероксидные радикалы в процессе окислительного фосфорилирования. Митохондрии – своеобразные «электростанции» клетки – являются главным постоянным источником АФК. Особенно активно радикалы генерируются при перегрузке митохондрий (например, при переедании и избытке калорий, когда митохондриальная цепь переноса электронов работает на пределе).
- Ферментативные реакции. Существуют ферменты, побочным продуктом работы которых являются свободные радикалы. К ним относятся NADPH-оксидазы (вырабатывают супероксид для уничтожения микробов иммунными клетками), ксантиноксидаза (продуцирует радикалы при метаболизме пуринов), NO-синтаза (при дефиците аргинина переключается на синтез супероксида вместо оксида азота), миелопероксидаза и др. При некоторых патологиях активность этих ферментов повышается, усиливая окислительный стресс.
- Воспаление и активация иммунитета. При хронических воспалительных процессах (например, в суставах при артрите или при инфекциях) иммунные клетки постоянно выбрасывают АФК как оружие против чужеродных агентов. Однако при длительном воспалении эти радикалы повреждают и здоровые ткани, поддерживая порочный круг – воспаление ⇄ окислительный стресс.
- Ионы переходных металлов. Избыток железа или меди в организме (например, при гемохроматозе или болезни Вильсона) может усилить генерацию радикалов через реакции Фентона – взаимодействие металлов с перекисью водорода приводит к образованию крайне агрессивного гидроксильного радикала •OH. Поэтому избыток железа, как ни парадоксально, тоже опасен – он выступает прооксидантом.
Экзогенные причины (внешние факторы):
- Курение. Табачный дым содержит множество свободных радикалов и токсичных соединений, повреждающих легочную ткань и истощающих запасы антиоксидантов (одна выкуренная сигарета может генерировать миллиарды свободных радикалов). У курящих системный уровень окислительного стресса значительно выше, что ускоряет повреждение сосудов и легких.
- Ультрафиолет и радиация. Жесткое УФ-излучение солнца, рентгеновские лучи и особенно ионизирующая радиация (радиационный фон, радиотерапия) – сильные инициаторы свободно-радикальных реакций. Под действием излучения молекулы воды в клетках распадаются с образованием •OH и других радикалов, которые атакуют ДНК и мембраны. Именно поэтому избыток солнца старит кожу (фотостарение) – виноваты свободные радикалы, образующиеся в коже под УФ.
- Токсины и загрязнители. Выхлопные газы, промышленные выбросы, тяжелые металлы (ртуть, кадмий, свинец) и пестициды могут либо сами являться прооксидантами, либо нарушать работу митохондрий и антиоксидантных ферментов. Например, диоксиды азота в смоговом воздухе превращаются в организме в нитрорадикалы, атакующие клетки легких.
- Нездоровое питание. Диета с высоким содержанием сахаров и переработанных продуктов способствует повышенному образованию АФК. Быстрые углеводы вызывают резкие скачки глюкозы в крови – глюкоза автокисляется и генерирует свободные радикалы, а также чрезмерно гликирует белки. Насыщенные и транс-жиры в избытке могут нарушать функцию митохондрий и эндотелия сосудов, повышая образование супероксида. Кроме того, дефицит антиоксидантов в пище (недостаток овощей, фруктов, зелени) означает, что внешняя подпитка антиоксидантной системы снижена. Итог – более уязвимые клетки.
- Хронический стресс. Эмоциональный и физический стресс запускает выброс гормонов (адреналин, кортизол), которые в длительной перспективе могут нарушать баланс про- и антиоксидантов. Стресс ассоциирован с воспалением и дисфункцией митохондрий, а значит – с ростом уровня АФК. Недаром у постоянно нервничающего человека могут проявляться «стрессовые» заболевания – гипертония, сердечные недуги – в развитии которых значим и окислительный стресс.
- Гипоксия. Недостаток кислорода (например, при ишемии, синдроме апноэ во сне или на больших высотах) парадоксально тоже ведет к окислительному стрессу. При резком возвращении кислорода после эпизодов гипоксии происходит всплеск образования радикалов (явление реперфузионного повреждения). Это наблюдается, например, при инфаркте миокарда, когда восстановление кровотока сопровождается атакой АФК на пострадавшую ткань сердца.
Когда перечисленные факторы (неправильное питание, курение, радиация, стресс и т.д.) действуют одновременно, они подавляют антиоксидантную систему и провоцируют избыточное образование АФК. Антиоксиданты расходуются быстрее, чем восполняются, активность защитных ферментов снижается. Итог – наступает окислительный стресс со всеми вытекающими повреждениями клеток.
Следует отметить, что оксидативный стресс – это не разовый эпизод, а нарастающий процесс. На первых порах организм компенсирует: активирует дополнительные ферменты, использует депо антиоксидантов (например, печеночные запасы витаминов). Человек может долго не чувствовать ничего особенного. Но при длительном воздействии вредных факторов скрытый дефицит антиоксидантов нарастает. Первые «тревожные звоночки» могут быть неспецифичны: хроническая усталость, частые головные боли, снижение концентрации, ухудшение состояния кожи. Эти симптомы окислительного стресса связаны с тем, что клетки мозга, сосудов и кожи работают в условиях постоянного окислительного удара и легкого воспаления. Если ничего не предпринять, со временем функциональные нарушения переходят в органические заболевания.
Чем опасен окислительный стресс для организма
Окислительный стресс называют «молчаливым убийцей» клеток. Его деструктивное действие не всегда сразу заметно, но происходит на уровне молекул и постепенно подтачивает здоровье. Чем опасен окислительный стресс? Проще говоря – тем, что ускоряет старение организма и является общей платформой для развития самых разных хронических болезней.
Свободные радикалы повреждают эндотелий сосудов, поэтому страдает кровообращение; бьют по нейронам мозга, нарушая нейронные связи; «поджигают» подкрепляющие воспаление в тканях. Исследования подтверждают, что хронический окислительный стресс сопровождает (и отчасти вызывает) сердечно-сосудистые заболевания, нейродегенеративные расстройства, диабет, остеопороз, ряд аутоиммунных и инфекционных болезней, а также участвует в инициации рака. Ниже рассмотрим некоторые патологии, наиболее тесно связанные с избыточным образованием АФК.
Заболевания ЦНС
Головной мозг особенно уязвим перед окислительным стрессом. Во-первых, нейроны потребляют огромное количество кислорода – около 20% всего О₂, поступающего в организм. Высокая интенсивность обмена означает и высокое фоновое образование АФК. Во-вторых, мозг на ~60% состоит из липидов (миелин, мембраны), а ненасыщенные жирные кислоты легко поддаются перекисному окислению. В-третьих, нейроны плохо обновляются, поэтому накопленные повреждения более критичны.
Избыток свободных радикалов в ЦНС приводит к повреждению липидов нейрональных мембран, нарушению работы митохондрий и высвобождению кальция внутри нейронов. В результате ухудшается передача нервных импульсов, ослабляются связи между отделами мозга, страдают память и когнитивные функции. Окислительный стресс в гиппокампе (зоне памяти) связывают с возрастным снижением памяти и деменцией. Кроме того, АФК активируют микроглию – иммунные клетки мозга, и провоцируют хроническое нейровоспаление.
Совокупность этих процессов рассматривается учеными как одна из ключевых причин нейродегенерации. Особенно прочна связь окислительного стресса с болезнью Альцгеймера и Паркинсона. В мозге пациентов с Альцгеймером находят повышенные уровни окисленных белков и липидов; АФК способствуют образованию токсичного бета-амилоида и тау-белка. При болезни Паркинсона гибнут дофаминергические нейроны – вероятно, из-за стресса от накопления свободных радикалов при метаболизме допамина и снижении уровня глутатиона (главного антиоксиданта мозга).
Кроме нейродегенеративных расстройств, окислительный стресс в ЦНС ассоциирован с психическими заболеваниями. Избыточное образование АФК в мозге обнаруживается у пациентов с депрессией, шизофренией, биполярным расстройством. Считается, что радикалы могут нарушать баланс нейромедиаторов и усиливать нейровоспаление, что отражается на настроении и поведении. Конечно, АФК – не единственный фактор риска этих болезней, но их роль подтверждена исследованиями. Например, в плазме больных депрессией часто снижен уровень антиоксидантов (витаминов E, C) и повышен уровень продуктов ПОЛ.
Таким образом, окислительный стресс – один из драйверов старения нервной системы и развития хронических болезней мозга. Замедление нейродегенерации – еще одна причина, почему важно контролировать уровень АФК.
Заболевания сердечно-сосудистой системы
Сердце и сосуды подвержены постоянному воздействию как внешних, так и внутренних прооксидантных факторов. Высокое давление кислорода в артериальной крови, механическая нагрузка, токсины из окружающей среды – все это создает предпосылки для окислительного стресса. Сосудистый эндотелий – внутренняя выстилка сосудов – особенно чувствителен к свободным радикалам. АФК повреждают эндотелиальные клетки и уменьшают выработку ими релаксирующего фактора – оксида азота (NO). Это ведет к спазму сосудов и повышению артериального давления (так возникает гипертония).
Поврежденный радикалами эндотелий легче пропускает внутрь сосудистой стенки холестериновыe частицы. Там они под действием тех же АФК превращаются в окисленный ЛНПН-холестерин, который активно поглощается макрофагами с образованием пенистых клеток. Так начинается атеросклероз – формирование холестериновых бляшек. Сужение просвета артерий из-за бляшек нарушает кровоснабжение тканей. Если поражены коронарные артерии сердца, развивается ишемическая болезнь сердца (ИБС) – сердце недополучает кислород, особенно при нагрузке. Образование тромба на разорвавшейся атеросклеротической бляшке может вызвать инфаркт миокарда (некроз участка сердечной мышцы). Аналогично, поражение артерий мозга приводит к инсульту.
Окислительный стресс участвует во всех стадиях атеросклероза – от начальной эндотелиальной дисфункции до разрыва бляшки. Он также усугубляет сердечную недостаточность (радикалы снижают сократимость миокарда) и аритмии. При сахарном диабете сочетание гипергликемии и окислительного стресса особенно разрушительно для сосудов, ускоряя развитие ангиопатий.
Недаром антиоксиданты и фитонутриенты исследуются как средства для профилактики ССЗ. Хотя полностью остановить прогрессию атеросклероза одними антиоксидантами не удалось, контроль окислительного стресса – важная часть кардиопрофилактики.
Сахарный диабет
При диабете, особенно 2 типа, возникает замкнутый круг: хронически высокий уровень глюкозы вызывает окислительный стресс, а окислительный стресс, в свою очередь, ухудшает течение диабета. Гипергликемия приводит к избыточному образованию АФК сразу по нескольким путям: автокисление глюкозы, активация полиолового пути (превращение глюкозы в сорбитол с генерацией радикалов), гиперактивность митохондрий в клетках поджелудочной железы. В результате растет уровень супероксида и других АФК.
Бета-клетки поджелудочной железы, вырабатывающие инсулин, очень чувствительны к свободным радикалам – у них относительно слабая антиоксидантная защита. При хроническом окислительном стрессе бета-клетки повреждаются, снижается секреция инсулина. Это усугубляет гипергликемию, замыкая порочный круг. Параллельно АФК вызывают резистентность к инсулину в мышцах и печени, вмешиваясь в инсулиновую сигнализацию.
Свободные радикалы активно участвуют в развитии осложнений диабета. Они ускоряют гликирование белков – образование конечных продуктов гликации (AGEs), которые повреждают сосуды. В мелких сосудах сетчатки глаза, почек, нервов на фоне гипергликемии и окислительного стресса развивается хроническое воспаление и эндотелиальная дисфункция. Итог – диабетическая ретинопатия (потеря зрения), нефропатия (почечная недостаточность) и нейропатия (повреждение нервов). Окислительный стресс признан одним из звеньев патогенеза синдрома диабетической стопы и сложно заживающих язв у диабетиков.
Важно, что снижение окислительного стресса у пациентов с диабетом способно улучшить их состояние. Например, антиоксиданты (витамины C, E, полифенолы) в исследованиях снижали уровень МДА и улучшали эндотелиальную функцию. Однако без контроля сахара одними антиоксидантами ситуацию не спасти. Главные меры – нормализация гликемии диетой, лекарствами и весом, что само по себе уменьшает образование радикалов. В этом смысле антиоксидантная терапия рассматривается лишь как дополнение к основному лечению диабета, направленному на разрыв порочного круга «гипергликемия – АФК – инсулинорезистентность».
Остеопороз
Мало кто связывает остеопороз (потерю костной массы) со свободными радикалами, однако в последние годы показано, что окислительный стресс играет роль и в этом процессе. Костная ткань постоянно обновляется: остеобласты строят новую кость, остеокласты разрушают старую. В норме этот процесс сбалансирован. Но при хроническом увеличении АФК равновесие смещается в сторону разрушения.
Одной из причин служит тот факт, что при оксидативном стрессе организм тратит поступающие минералы (кальций, магний) и витамин D не на строительство кости, а на более неотложные нужды – попытку нейтрализовать избыток кислот и радикалов. Согласно одной гипотезе, хроническое микроскопическое “закисление” организма (ацидоз), связанное с диетой и стрессом, заставляет вытягивать кальций из костей для буферизации кислот. АФК могут активировать остеокласты – клетки, разрушающие костную ткань, и ингибировать остеобласты. В результате кости истончаются и становятся хрупкими.
Исследования показывают повышенный уровень окисленных белков и липидов в крови пожилых людей с остеопорозом. Мыши с искусственно усиленным окислительным стрессом теряют кость быстрее. Напротив, диеты, богатые антиоксидантами (овощи, фрукты) и фитонутриентами, коррелируют с более высокой плотностью костей у людей. В клинических рекомендациях по профилактике остеопороза уже упоминается отказ от курения и алкоголя как меры снижения окислительного стресса. Конечно, ведущую роль в здоровье костей играют гормоны и уровень кальция/витамина D, но учёт антиоксидантного статуса – перспективное направление в комплексной профилактике остеопороза у пожилых.
Онкологические заболевания
Свободные радикалы способны превращать нормальные клетки в раковые. Механизмы двоякие: во-первых, прямое повреждение ДНК радикалами вызывает мутации в генах (в том числе онкогенах и генах-супрессорах опухолей). Во-вторых, хроническое воспаление на фоне окислительного стресса стимулирует деление клеток и может активировать спящие опухолевые клетки.
Ещё в 1980-х годах была сформулирована теория, что рак – следствие накопления свободно-радикальных повреждений ДНК. Действительно, многие канцерогены либо являются прооксидантами (например, ультрафиолет, радиация, бензпирен в сигаретах), либо метаболизируются с образованием радикалов. АФК вызывают типичные для рака мутации: разрывы ДНК, трансверсии оснований, хромосомные аберрации. Если такая мутация затронет, скажем, ген, контролирующий клеточный цикл, клетка может выйти из-под контроля и начать безудержно делиться – так зарождается опухоль.
Кроме того, окислительный стресс сопровождает любое хроническое воспаление, а известно, что длительно текущие воспалительные заболевания увеличивают риск рака. Пример – гепатит C и рак печени, хронический колит и рак кишечника. В этих случаях свободные радикалы, постоянно генерируемые воспалительными клетками, повреждают ДНК и одновременно стимулируют пролиферацию клеток для заживления – почва для ошибок репликации. АФК могут активировать определенные сигнальные пути, ведущие к экспрессии онкогенов и факторов роста опухоли.
Когда опухоль уже возникла, окислительный стресс способствует ее прогрессированию. Радикалы подавляют апоптоз – механизм, через который организм устраняет дефектные клетки. Кроме того, в опухолевой среде часто наблюдается высокое содержание АФК, что помогает раковым клеткам избегать иммунного надзора и стимулирует образование новых мутаций, приводящих к лекарственной устойчивости. Парадокс: раковые клетки приспосабливаются к жизни в условиях окислительного стресса, а вот нормальные клетки вокруг страдают и гибнут.
Подводя итог, хронический окислительный стресс увеличивает риск онкологических заболеваний. Поэтому рекомендации по профилактике рака всегда включают отказ от курения, правильное питание, борьбу с воспалением – факторы, снижающие уровень АФК. Однако лечение уже возникших опухолей антиоксидантами – спорный вопрос: высокие дозы антиоксидантов могут, напротив, защитить рак от химиотерапии (которая убивает клетки через образование свободных радикалов). Этот нюанс ещё раз подчеркивает: важен баланс и точечный подход, а не просто «чем больше антиоксидантов, тем лучше».
Как измерить и диагностировать окислительный стресс
Окислительный стресс – состояние скрытое, и по одним только симптомам (таким как усталость или головные боли) его не диагностировать. Требуется лабораторная оценка биомаркеров окислительного стресса. В научных и клинических исследованиях для этого используют несколько показателей:
- Продукты перекисного окисления липидов: самый известный – малоновый диальдегид (МДА). Его уровень в крови или моче отражает интенсивность ПОЛ мембран. Также измеряют F₂-изопростаны – молекулы, образующиеся из арахидоновой кислоты под действием свободных радикалов. Повышенная концентрация F₂-изопростанів в моче считается надежным маркером окислительного повреждения липидов.
- Маркер повреждения ДНК: 8-oxo-дезоксигуанозин (8-oxo-dG) – продукт окисления гуанина в ДНК. Выявляется в моче; его избыток сигнализирует, что радикалы атакуют генетический материал. Высокий уровень 8-oxo-dG ассоциирован с риском рака и старением.
- Окисленные белки: можно измерять содержание карбонильных групп в белках плазмы – они появляются при окислении аминокислот.
- Активность антиоксидантных ферментов: оценивают активность супероксиддисмутазы (SOD), каталазы, глутатионпероксидазы (GPx) в эритроцитах или тканях. Снижение активности этих ферментов говорит об истощении антиоксидантной защиты или о генетических/нутритивных проблемах (например, дефицит селена бьет по активности GPx).
- Общий антиоксидантный статус (TAC): суммарная способность крови нейтрализовать стандартный окислитель. Определяется с помощью специальных тестов (FRAP, ORAC и др.). Низкий TAC означает слабый резерв защиты.
В современной функциональной медицине существуют панели анализов на окислительный стресс. Например, некоторые лаборатории предлагают «комплексную оценку оксидативного стресса», включающую определение МДА, 8-оксогуанозина, антиоксидантов (витамин E, коэнзим Q10) и ферментов в крови. Подобные тесты помогают количественно оценить баланс про- и антиоксидантов у человека. Однако интерпретировать их должен специалист.
Важно, что диагностика окислительного стресса не ограничивается одним анализом. Лучший подход – смотреть в комплексе: и маркеры повреждений, и состояние антиоксидантной системы. Например, высокие уровни МДА при низкой активности SOD и низком уровне витамина C в плазме однозначно укажут на присутствие оксидативного стресса.
В рутинной клинической практике такие тесты пока используются ограниченно. Но в исследовательских работах высокие уровни названных маркеров четко коррелируют с наличием заболеваний, вызванных окислительным стрессом. В перспективе, возможно, оценка окислительного статуса станет такой же привычной, как анализ холестерина – особенно для людей с факторами риска (курящие, диабетики, жители мегаполисов).
Отдельно стоит отметить, что существуют простые косвенные индикаторы. Например, постоянное повышение уровня ферритина при отсутствии инфекции может указывать на скрытое хроническое воспаление и окислительный стресс. Также тест на 8-оксогуанин в моче предлагается как скрининг “уровня окисленного ДНК”. Но эти методы скорее ориентировочные.
Вывод: обнаружить окислительный стресс можно, и в арсенале есть достаточно лабораторных маркеров. Если у человека имеются несколько хронических заболеваний или факторов риска, имеет смысл обсудить с врачом возможность такой диагностики. Узнав о проблеме, легче подобрать целевые меры для ее решения – и ответственно относиться к назначениям врача.
Роль антиоксидантов в защите клеток
К счастью, природа предусмотрела противоядие от агрессивных радикалов – это антиоксидантная система организма. Антиоксиданты – это вещества, которые способны нейтрализовать свободные радикалы, отдавая им свой электрон или иным способом стабилизируя. Таким образом, антиоксиданты защищают клетки от окислительного стресса, прерывая разрушительные цепные реакции.
Антиоксидантная система сложна и многоуровневая. Принято делить антиоксиданты на эндогенные (внутренние, которые вырабатывает сам организм) и экзогенные (поступающие с пищей), а также на ферментные и неферментные. Рассмотрим основные компоненты этой системы:
- Ферментные антиоксиданты (первичная линия защиты): это ферменты, которые напрямую обезвреживают АФК. К ним относятся:
- Супероксиддисмутаза (SOD). Превращает супероксидный радикал O₂•⁻ в перекись водорода (H₂O₂). SOD присутствует во всех клетках (есть несколько форм – в митохондриях, цитоплазме). Для работы ей нужны микроэлементы цинк, медь и марганец – без них активность SOD падает.
- Каталаза. Расщепляет перекись водорода на воду и кислород, устраняя эту относительно длительно живущую АФК до того, как из нее образуется гидроксильный радикал. Каталаза особенно активна в печени.
- Глутатионпероксидаза (GPx). Тоже нейтрализует перекись водорода, но используя восстановленный глутатион (GSH). Входит в состав селен (поэтому при дефиците селена GPx неэффективна). GPx защищает клеточные мембраны от перекисей.
- Глутатион-редуктаза и глутатион-S-трансфераза. Восстанавливают окисленный глутатион и выводят из организма продукты окисления, связывая их с глутатионом.
Эти ферментные системы работают мгновенно и предотвращают образование новых радикалов (например, удаляя H₂O₂ до превращения в •OH).
- Неферментные антиоксиданты (вторичная линия защиты): это разнообразные молекулы, которые сами по себе вступают в реакцию со свободными радикалами, обезвреживая их. К ним относятся:
- Глутатион (GSH). Главный низкомолекулярный антиоксидант внутри клеток. Состоит из трех аминокислот (цистеина, глутаминовой кислоты (глутамата) и глицина), синтезируется в печени. Глутатион напрямую нейтрализует радикалы, превращаясь в окисленную форму (GSSG), затем восстанавливается обратно. Уровень глутатиона – ключевой показатель антиоксидантного статуса клетки.
- Витамин C (в частности, аскорбиновая кислота). Растворимый в воде антиоксидант, который “вылавливает” радикалы в плазме и цитоплазме. Особенно эффективен против радикалов, возникающих под действием загрязнений и сигаретного дыма. Также восстанавливает окисленный витамин E, работая в паре.
- Витамин E (в частности, токоферолы, особенно α-токоферол). Жирорастворимый антиоксидант, встроенный в липидные мембраны. Он разрывает цепную реакцию ПОЛ, отдавая электрон липидному радикалу и превращаясь в относительно стабильный радикал токоферола, который затем восстанавливается витамином C. Достаточное поступление витамина E с пищей (орехи, масла) защищает мембраны клеток мозга, сосудов, кожи.
- Каротиноиды (бета-каротин, ликопин, лютеин и др.). Пигменты растений, многие из которых – провитамины A. Они способны тушить синглетный кислород (особый возбужденный вид кислорода) и обезвреживать радикалы в липидной фазе. Например, ликопин из томатов эффективен против радикалов в коже (защита от фотоповреждений).
- Коэнзим Q10 (убихинол). Важный компонент митохондрий, участвующий в синтезе АТФ. В восстановленной форме Q10 сам ловит радикалы и предотвращает окисление липидов мембран. Уровень Q10 снижается с возрастом, поэтому его иногда дополнительно принимают для поддержания энергии и антиоксидантной защиты сердца.
- Флавоноиды и полифенолы. Растительные антиоксиданты (кверцетин, ресвератрол, катехины чая, проантоцианиды винограда и т.д.). Они способны хелатировать металлы (связывать железо, препятствуя реакциям Фентона) и прямо нейтрализовать ряд радикалов. Диета, богатая полифенолами, ассоциирована с низким уровнем воспаления и окислительного стресса.
- Эндогенные высокомолекулярные соединения: альбумин плазмы, церулоплазмин, трансферрин. Эти белки связывают избыточные ионы металлов (медь, железо), не давая им участвовать в образовании радикалов. Также к этой группе относят ферритин (хранит железо в неактивной форме) и металлотионины (белки, связывающие тяжелые металлы и лишние радикалы).
Антиоксиданты работают согласованно. Часто один радикал последовательно обезвреживается несколькими звеньями: например, супероксид → SOD превращает в H₂O₂ → каталаза или GPx превращают H₂O₂ в воду, при этом окисляется глутатион → глутатион-редуктаза восстанавливает GSH, расходуя NADPH (который, в свою очередь, регенерируется в пентозофосфатном пути). Это сложная сеть, где каждое звено важно. Если не хватает какого-то витамина (кофактора) или снижен активность фермента – общая эффективность защиты падает.
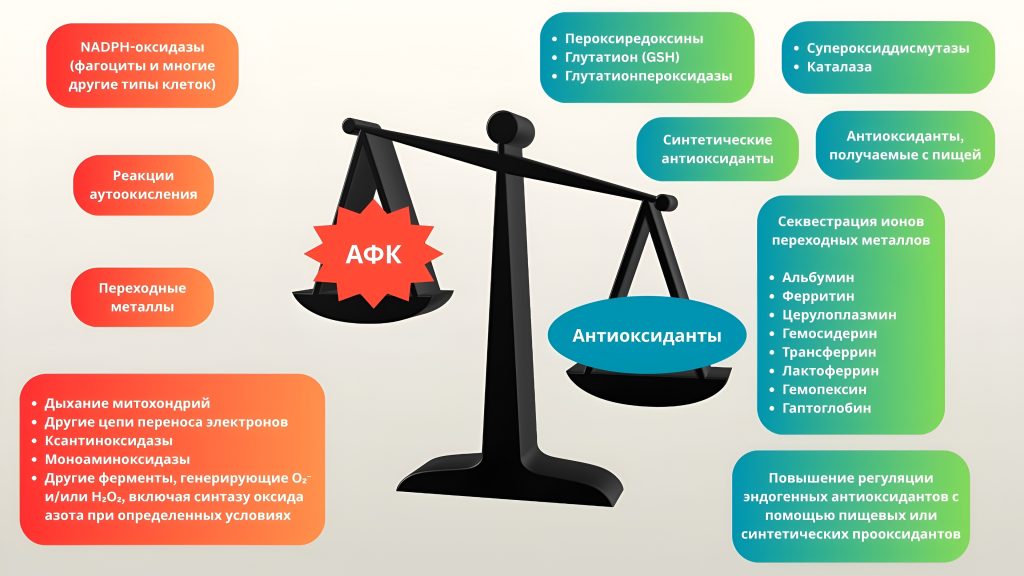
Баланс между продукцией активных форм кислорода и антиоксидантной защитой организма. Источник: Halliwell, B. Understanding mechanisms of antioxidant action in health and disease. Nat. Rev. Mol. Cell Biol. 2024, 25, 13–33
Следует подчеркнуть: антиоксиданты не взаимозаменяемы. Каждый действует в своей среде и против определенных окислителей. Например, витамин E работает в жировых мембранах, а витамин C – в водной среде крови; SOD борется с супероксидом, а каталаза – с перекисью. «Пропустить вперед» друг друга они не могут. Поэтому необходимо разнообразие антиоксидантов. Один мощный антиоксидант не способен нейтрализовать все виды свободных радикалов.
Организм старается поддерживать антиоксидантный щит на максимуме. Когда факторов стресса мало, антиоксидантные системы работают в штатном режиме. При возрастании АФК включаются дополнительные механизмы: активируется транскрипционный фактор Nrf2, который усиливает синтез ферментов детокса и антиоксидантов; из депо (печени, жировой ткани) мобилизуются жирорастворимые витамины; усиливается поглощение аскорбата тканями. Однако эти резервы небезграничны – при хронической перегрузке их не хватает.

Классификация антиоксидантов. Источник: C.M.C. Andrés, et al. Antioxidant Metabolism Pathways in Vitamins, Polyphenols, and Selenium: Parallels and Divergences. Int. J. Mol. Sci., 2024, 25 (5), 2600.
Поддерживать антиоксидантную систему можно и нужно. Основные способы: обеспечить поступление с пищей всех необходимых витаминов и микроэлементов, избегать лишних прооксидантов (например, не жарить пищу до гари – продукты горения содержат радикалы), вести образ жизни, при котором внутренние антиоксиданты эффективно обновляются (сон, умеренная физическая активность стимулируют синтез антиоксидантных ферментов). Об этом – в разделе практических рекомендаций.
Почему прием витаминов может быть опасен
Логично предположить: раз свободные радикалы вредны, а антиоксиданты полезны, то надо принимать антиоксидантные витамины в больших дозах для здоровья. Однако все не так просто. Избыточный прием синтетических витаминов-антиоксидантов может быть вреден. В ряде крупных исследований неожиданно выяснилось, что высокие дозы отдельных антиоксидантов не только не продлевают жизнь, но и могут повысить заболеваемость и смертность.
Например, еще в 1990-х было проведено крупное исследование ATBC с участием более 29 тысяч курящих в Финляндии. Им давали добавки синтетического бета-каротина (провитамина A) в высоких дозах в надежде снизить риск рака легких (так как у курильщиков окислительный стресс высок). Результат оказался противоположным: у получавших такой бета-каротин мужчин заболеваемость раком легких увеличилась примерно на 18% по сравнению с плацебо. Другое исследование (CARET, США) тоже досрочно остановили, обнаружив рост рака легких на фоне больших доз бета-каротина и ретинола.
Мета-анализ 68 исследований, охвативших ~232 тысячи человек, показал, что долгосрочный прием витамина E, бета-каротина и ретинола достоверно повышает общую смертность (от всех причин) на 4–7%. Витамин C и селен не влияли на смертность, но и не продемонстрировали однозначной пользы. Вывод авторов: антиоксидантные добавки не предотвращают сердечно-сосудистые заболевания или рак, а некоторые даже могут навредить. PubMed, ID 17327526 (Bjelakovic et al., JAMA, 2007). Синтетические формы и высокие дозы (часто многократно выше суточных норм) — характерная черта этих исследований, особенно для бета-каротина и витамина А. Комплексные добавки там использовались редко — как правило, изучался изолированный один компонент или простая смесь.
Почему так происходит? Во-первых, среда имеет значение. Антиоксидант, попав в условия сильного окислительного стресса, сам может превратиться в прооксидант. Например, витамин C в присутствии избытка ионов железа способен генерировать гидроксильные радикалы (реакция Фентона). В норме в организме есть механизмы, не допускающие этого, но при неестественно высоких дозах баланс тонкий. Во-вторых, нарушается тонкая регуляция. Вспомним, что АФК – не только зло, они участвуют в клеточной сигнализации. Когда мы начинаем бесконтрольно подавлять их высокими дозами антиоксидантов, можно “отключить” важные сигнальные пути. Например, чрезмерное подавление АФК в опухоли может защитить раковые клетки от апоптоза, способствуя их выживанию. Известно, что у курильщиков, принимавших бета-каротин, помимо рака увеличилась частота инсультов – возможно, из-за нарушения адаптивных реакций сосудов.
Кроме того, все антиоксиданты действуют совместно, и избыток одного может привести к дефициту другого. Организм – не пробирка: высокие концентрации антиоксидантов могут подавлять собственную выработку ферментов. Есть данные, что длительный прием больших доз альфа-токоферола снижает уровень коэнзима Q10 и гамма-токоферола в крови (других важных антиоксидантов).
Природный витамин Е — это смесь, объединяющая восемь родственных соединений: четыре токоферола (альфа-, бета-, гамма- и дельта-) и четыре токотриенола с теми же приставками. Всегда представлен в форме D- (dextrorotatory, правовращающей).
Природный витамин С — это, прежде всего, аскорбиновая кислота в сочетании с сопутствующими фитокомпонентами (биофлавоноидами, аскорбигеном, дегидроаскорбиновой кислотой, иногда аскорбилпальмитатом). В овощах, фруктах, ягодах содержится только L-форма.
Отдельный риск – токсичность жирорастворимых витаминов. Витамин A (ретинол) и витамин E в сверхдозах накапливаются и могут вызывать отравление. Гипервитаминоз A приводит к повреждению печени, остеопорозу, врожденным порокам у плода. Избыток витамина E нарушает свертываемость крови и связан с повышенным риском геморрагического инсульта.
Важно понимать: пищевые продукты с антиоксидантами не опасны, речь именно о фармдозах из дешевых добавок. В еде антиоксиданты сбалансированы и сопровождаются сотнями фитонутриентов, которые действуют комплексно. Съесть слишком много моркови, чтобы заболеть от бета-каротина, практически невозможно (лишний бета-каротин просто придаст коже оранжевый оттенок, но не станет прооксидантом). А вот концентрированные капсулы – другое дело.
Это не означает, что витамины – зло. Дефицит антиоксидантов тоже вреден, и людям с установленным дефицитом добавки необходимы. Важно выбирать качественный БАД, содержащий нутриент в природной форме там, где это важно (например, витамины А, С, Е). Опасен именно избыток, особенно без показаний. Поэтому врачи призывают не принимать постоянно высокие дозы витаминов A, E, C без нужды.
Вывод простой: не стоит бездумно глотать антиоксидантные добавки “для профилактики”. Гораздо полезнее скорректировать рацион, добавив природных антиоксидантов (овощи, фрукты, зелень, орехи), чем пить горсти пилюль. Если же есть показания (например, врач выявил низкий уровень селена или витамина E) – добавки с правильными формами и комбинацией антиоксидантов применяются в адекватных дозах и под контролем. В отношении антиоксидантов верно правило: лучше – враг хорошего. Баланс и умеренность – залог пользы.
Научный взгляд: что подтверждает PubMed?
Современные исследования активно изучают окислительный стресс и методы борьбы с ним. Ниже – несколько примеров актуальных научных данных:
- Оксидативный стресс при гипертонии и диабете: Обзор 2025 года подчеркнул, что АФК являются ключевым звеном, связывающим высокое давление и диабет. Маркеры окислительного стресса – такие как F₂-изопростаны (показатель ПОЛ) и 8-оксогуанин (показатель повреждения ДНК) – хорошо коррелируют с прогрессированием гипертензии и сахарного диабета и развитием осложнений. Несмотря на многообещающие результаты в экспериментах, антиоксидантные таблетки в клинике дали противоречивый эффект. Ученые делают ставку на таргетные подходы: антиоксиданты, адресно действующие на митохондрии в сосудах, активаторы Nrf2 для восстановления баланса на ранних стадиях диабета, ингибиторы фермента NOX (генератора супероксида) – все это тестируется на моделях. Также предлагаются интегративные стратегии: сочетание медикаментов с изменением образа жизни (средиземноморская диета, регулярные упражнения) дает дополнительную пользу в снижении оксидативного стресса у этих пациентов. Источник: PubMed, ID 40492113.
- Диета и снижение окислительного стресса: Систематический обзор клинических исследований (2020) показал, что питание, богатое антиоксидантами и полифенолами, в сочетании с похудением существенно уменьшает показатели оксидативного стресса у людей с метаболическими нарушениями (ожирение, гипертония, диабет). В частности, у пациентов, которые придерживались растительной диеты с большим количеством овощей, фруктов, орехов и ограничением калорий, отмечалось снижение уровней МДА и увеличение активности эндогенных антиоксидантных ферментов. Даже замена части животного белка на растительный и добавление клетчатки приводили к положительным сдвигам – вероятно, через улучшение микрофлоры кишечника и снижение системного воспаления. Вывод ученых: здоровое питание и нормализация веса укрепляют антиоксидантную защиту. Это подтверждает концепцию интегративной медицины, где изменение образа жизни – краеугольный камень профилактики оксидативного стресса. Источник: PubMed, ID 32160647.
- Витаминные антиоксиданты и риски: Крупный метаанализ (68 РКИ) под эгидой Cochrane заключил, что длительный прием высоких доз витаминов A, E и бета-каротина ассоциирован с увеличением смертности. В 47 строгих исследованиях антиоксидантные добавки повышали риск умереть в среднем на 5%. В частности, бета-каротин увеличивал смертность на 7%, ретинол – на 16%, а токоферол – на 4%. Результаты заставили научное сообщество осторожнее подходить к идее “таблеток от старости” из антиоксидантов. Предполагается, что сверхдозы витаминов нарушают естественные сигнальные пути и могут сами играть прооксидантную роль в определенных условиях. Так или иначе, оптимизация питания выигрывает у таблетированных антиоксидантов (а назначаются чаще всего именно аптечные синтетические витамины) с точки зрения продления жизни. Источник: PubMed, ID 17327526.
- Нейродегенерация и АФК: Свежий обзор 2025 года подтвердил, что хронический окислительный стресс – один из драйверов нейродегенеративных болезней (Альцгеймера, Паркинсона, Хантингтона, БАС). Мозг уязвим из-за высокого потребления кислорода и липидного состава; при избытке радикалов происходит окисление белков и липидов нейронов, активируется нейровоспаление, что приводит к дисфункции и гибели нейронов. У больных Альцгеймером отмечены повышенные уровни продуктов ПОЛ в мозге, а у пациентов с болезнью Паркинсона – снижение уровня глутатиона в субстанции нигра. В обзоре отмечается, что антиоксидантные терапевтические подходи (например, молекулы, проходящие гематоэнцефалический барьер и восстанавливающие уровень GSH в нейронах) представляют интерес, но клинически значимого эффекта пока не достигнуто. Тем не менее, авторы подчеркивают профилактическую роль образа жизни: диета, богатая овощами/фруктами, и регулярная физическая активность связаны со снижением риска деменции, возможно, благодаря уменьшению оксидативного стресса. Источник: PubMed, ID 40563328.
В совокупности исследования подтверждают: окислительный стресс – не абстракция, а измеримая реальность, влияющая на здоровье. Подтверждена его роль в патогенезе множества заболеваний. Однако и бороться с ним нужно грамотно, учитывая тонкости биохимии. Простое заглатывание антиоксидантов – не панацея; гораздо перспективнее комплексные стратегии (диета, образ жизни + таргетные препараты), основанные на данных науки.
Практические рекомендации от команды и профессора Дадали
Чтобы снизить окислительный стресс и защитить клетки, необходим комплексный подход – изменение образа жизни и питания с учетом индивидуальных особенностей.
- Ешьте больше овощей и фруктов каждый день. Старайтесь включать в рацион не менее 5 порций разнообразных овощей и фруктов в сутки. Особое внимание – ярко окрашенным продуктам: ягоды, чернослив, цитрусовые, киви, болгарский перец, томаты, шпинат, брокколи. Они богаты витаминами C, E, каротиноидами и полифенолами – природными антиоксидантами. Например, черника и гранат богаты антоцианами, томаты – ликопином, морковь и тыква – бета-каротином, зелень – витамином C. Разноцветная тарелка = широкий спектр антиоксидантов. Помните, что растительные антиоксиданты лучше усваиваются из цельных продуктов (благодаря сопутствующим нутриентам), чем из добавок с изолированным веществом.
| Антиоксидант | Функция | Основные пищевые источники |
| Витамин C (природная форма) | Водорастворимый антиоксидант; регенерирует витамин E; защищает ДНК и белки | Чёрная смородина, киви, болгарский перец, цитрусовые, клубника, брокколи, шиповник |
| Витамин E (токоферолы и токотриенолы) | Жирорастворимый антиоксидант; защищает клеточные мембраны от перекисного окисления | Миндаль, подсолнечные семечки, грецкие орехи, авокадо, растительные масла (зародышей пшеницы, подсолнечное, оливковое, красное пальмовое) |
| Бета-каротин (провитамин A) | Нейтрализует синглетный кислород, защищает липиды; предшественник ретинола | Морковь, тыква, сладкий картофель, шпинат, капуста кале, абрикосы |
| Ликопин | Каротиноид; защищает от окисления ЛПНП, снижает фотостарение | Томаты (особенно приготовленные с маслом), арбуз, гуайява, розовый грейпфрут |
| Лютеин и зеаксантин | Защищают сетчатку глаза от УФ-и окислительного повреждения; концентрируются в макуле | Шпинат, капуста кале, брокколи, яичный желток, кукуруза |
| Полифенолы / Флавоноиды | Противовоспалительные; хелатируют металлы; активируют Nrf2 и подавляют NF-κB | Ягоды, какао, зелёный чай, яблоки, цитрусовые, красное вино (умеренно) |
| Антоцианы | Укрепляют сосуды, защищают мозг; снижают воспаление | Черника, черноплодная рябина, вишня, ежевика, краснокочанная капуста, тёмный виноград |
| Ресвератрол | Активирует сиртуины (SIRT1); противовоспалительный и кардиозащитный эффект | Кожура красного винограда, красное вино (умеренно), арахис, черника |
| Кверцетин | Снижает воспаление, стабилизирует тучные клетки, хелатирует железо | Лук (особенно красный), яблоки, каперсы, брокколи, цитрусовые |
| Коэнзим Q10 (убихинол) | Митохондриальный антиоксидант; участвует в синтезе АТФ; уровень снижается с возрастом | Жирная рыба (скумбрия, сардины), печень, говядина, кунжут, орехи |
| Селен | Кофактор глутатионпероксидазы (GPx); поддерживает иммунитет | Бразильские орехи (1–2 в день), морепродукты, тунец, яйца, цельнозерновые |
| Цинк и медь | Кофакторы супероксиддисмутазы (SOD); поддерживают баланс антиоксидантных ферментов | Устрицы, мясо, тыквенные семечки (цинк); орехи, чечевица, какао (медь) |
| Предшественники глутатиона (цистеин, глицин, глутамат) | Обеспечивают синтез главного внутриклеточного антиоксиданта GSH | Чеснок, лук, брокколи, цветная капуста, шпинат, капуста кале |
- Обеспечьте поступление достаточного белка и микроэлементов. Антиоксидантные ферменты содержат в своем составе цинк, медь, железо, селен, марганец. Позаботьтесь о наличии этих элементов в питании. Ешьте орехи и семечки (источник селена – бразильский орех, источник цинка – тыквенные семечки), морепродукты и рыбу (селен, цинк, медь), цельнозерновые. Белок необходим для синтеза глутатиона и ферментов – включайте в рацион нежирное мясо, рыбу, бобовые или качественные молочные продукты. Недостаток селена или цинка делает антиоксидантную защиту уязвимой – по необходимости проверяйте их уровень и консультируйтесь с врачом о приеме добавок.
Читайте также: Минералы и защита от окислительного стресса
- Ограничьте воздействие известных прооксидантов. Прекратите курение – это один из мощнейших источников радикалов (каждая сигарета истощает запасы витамина C примерно на 25 мг). Избегайте пассивного курения. Сведите к минимуму употребление жареной, копченой пищи – при сильном нагреве масел образуются липидные радикалы. Алкоголь потребляйте умеренно: в больших количествах он вызывает образование АФК и истощает глутатион в печени. Защищайте кожу от избыточного ультрафиолета с помощью одежды и крема – это предотвратит фотостарение и снизит оксидативный стресс в коже. Если живете в мегаполисе с плохим воздухом, по возможности используйте воздухоочистители дома, чаще гуляйте в парках – уменьшение контакта с токсинами воздуха напрямую снижает уровень АФК в крови.
- Поддерживайте здоровый вес и будьте физически активны. Жировая ткань при избытке становится источником воспалительных факторов, повышающих окислительный стресс. Снижение веса при ожирении приводит к уменьшению уровня системного воспаления и радикалов. Комбинация правильного питания и регулярных физических нагрузок – лучшая стратегия. Однако важно помнить про меру: умеренные нагрузки (кардиотренировки 3–5 раз в неделю по 30–45 минут или силовые тренировки 2–3 раза) стимулируют антиоксидантные ферменты и повышают устойчивость к стрессу. А вот перетренированность, наоборот, может повысить окислительный стресс. Прислушивайтесь к организму, чередуйте нагрузку и отдых. После тренировок восполняйте уровень антиоксидантов через питание (например, ягодный смузи, овощной салат).
- Управляйте стрессом и высыпайтесь. Хронический психоэмоциональный стресс повышает уровень гормонов, которые усиливают образование АФК. Практикуйте техники релаксации: дыхательные упражнения, йогу, медитацию, прогулки на природе. Поддерживайте здоровый режим сна – 7–8 часов ночью. Во время глубокого сна активируется выработка антиоксидантных молекул (например, мелатонин – гормон сна – сам является антиоксидантом и помогает нейтрализовать радикалы мозга). Постарайтесь за 1–2 часа до сна уменьшить свет от экрана и расслабиться – это повысит качество сна и снизит уровень оксидативного стресса.
- Принимайте грамотно составленные антиоксидантные добавки при необходимости. Если у вас подтвержденный дефицит витаминов-антиоксидантов или микроэлементов (витамина C, E, D, селена, цинка и т.д.) или скудное питание, восполнять его необходимо – но под контролем специалиста. Профилактический бесконтрольный прием высоких доз дешевых синтетических антиоксидантов не рекомендуется. Если и применять нутрицевтики, то в правильных формах, например:
Витамин C: L-аскорбиновая кислота, аскорбат натрия/кальция/магния, липосомальная форма + биофлавоноиды (например, рутин, гесперидин, цитрусовые биофлавоноиды и др.). В идеале – сопровождаются экстрактом ацеролы или другого источника природного витамина. Если такового нет, можно дополнительно готовить и принимать экстракт шиповника и есть цитрусовые с кожурой. Не рекомендуются: синтетические D,L-формы.
Витамин E: d-альфа-токоферол (натуральная форма, RRR-alpha-tocopherol) — самый активный и безопасный для длительного приема. В идеале — комплекс токоферолов (альфа-, бета- гамма-, дельта-) и токотриенолов (альфа-, бета- гамма-, дельта-) из растительных масел. Не рекомендуются: синтетический DL-альфа-токоферол, токоферила ацетат, если их используют отдельно и тем более в мегадозах.
Помните: избыток антиоксидантов может навредить так же, как и их недостаток. Всегда сообщайте врачу о всех принимаемых БАДах.
- Консультируйтесь со специалистами по интегративной медицине. Порой причиной избыточного оксидативного стресса могут быть скрытые проблемы: хронические инфекции, дисбактериоз кишечника, накопление тяжелых металлов, гормональные дисбалансы. В таких случаях нужно адресно решать первопричину. Врач интегративной (функциональной) медицины поможет взглянуть комплексно: проверить состояние кишечной микробиоты (ее дисбаланс способен повышать системное воспаление и АФК), оценить уровень хронического воспаления (например, по высокочувствительному СРБ), назначить при необходимости детокс-терапию (например, вывести избыток железа или других металлов). Цель – устранить корневой фактор, а не только принимать антиоксиданты сверху. Такой подход гораздо эффективнее снижает окислительный стресс в долгосрочной перспективе.
Выполнение этих рекомендаций поможет вашему организму держать под контролем уровень свободных радикалов. Помните, что здоровый образ жизни – лучшая антиоксидантная стратегия. Наш организм эволюционно приспособлен справляться с окислительным стрессом, если мы не мешаем ему неправильными привычками. Поддерживая его правильным питанием, движением и отдыхом, мы даем своему “антиоксидантному щиту” работать на полную силу.
Выводы
Окислительный стресс – это невидимый враг, действующий на клеточном уровне. Простыми словами, это «биохимический перекос», когда в организме слишком много агрессивных окислителей и слишком мало защитников-антиоксидантов. В краткосрочной перспективе мы этого можем не чувствовать, но в долгосрочной – окислительный стресс способствует старению и развитию болезней. Современная наука убедительно связывает хронический избыток АФК с атеросклерозом, болезнями мозга, диабетом, катарактой, онкологией и даже снижением иммунитета.
Но ситуация не безнадежна. У нас есть мощная врожденная антиоксидантная система, и мы можем помочь ей, ведя правильный образ жизни. Сбалансированная диета, богатая натуральными антиоксидантами, прием качественных добавок при необходимости, отказ от курения и токсинов, управление стрессом, достаточный сон и физическая активность – вот простые, но эффективные инструменты снижения окислительного стресса. Это подтверждается и научными данными, и практикой функциональной медицины.
Важно помнить о балансе: цель – не полностью подавить все радикалы (это и невозможно, и вредно), а поддерживать перекисный гомеостаз – равновесие между образованием АФК и их нейтрализацией. Природа мудро предусмотрела, что нам нужны и те и другие в меру. Поэтому бездумное поедание горстей витаминов (особенно дешевых форм) – не панацея, а иногда и риск. Гораздо разумнее – комплексный и персонализированный подход. Именно его продвигает профессор Дадали и его команда: оценка индивидуального статуса (анализы, анамнез), выявление скрытых дефицитов или перегрузок, и адресная коррекция питания, образа жизни и при необходимости – добавок.
В итоге борьба с окислительным стрессом сводится к общей концепции здорового образа жизни. Недаром все рекомендации по долголетию включают овощи-фрукты, отказ от курения, физическую активность. Через призму свободно-радикальной теории это выглядит еще логичнее: мы минимизируем образование “внутренней ржавчины” и помогаем телу самоочищаться.
Вывод: заботясь об антиоксидантном балансе, мы закладываем фундамент активного долголетия. Пусть ваш “окислительный стресс” остается только научным термином, а не диагнозом. Берегите себя – и ваши клетки скажут вам спасибо, отвечая энергией, молодостью и здоровьем на долгие годы.
Источники
- Sies H. Oxidative stress: Introductory remarks [Оксидативный стресс: вводные замечания], In: Sies H (ed.) Oxidative Stress. London: Academic Press, 1985. (Первое определение термина «оксидативный стресс»)
- Oxidative Stress: Pathological Driver in Chronic Neurodegenerative Diseases [Окислительный стресс: патологический фактор хронических нейродегенеративных заболеваний], Antioxidants (Basel) (2025). PubMed, ID 40563328
- Linking oxidative stress biomarkers to disease progression and antioxidant therapy in hypertension and diabetes mellitus [Связь биомаркеров окислительного стресса с прогрессией заболевания и антиоксидантной терапией при артериальной гипертензии и диабете], Front Mol Biosci. (2025). PubMed, ID 40492113
- The effect of diet on oxidative stress and metabolic diseases – clinically controlled trials [Влияние рациона на окислительный стресс и метаболические болезни — клинические исследования], J. Food Biochem. (2020). PubMed, ID 32160647
- Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: meta-analysis [Смертность в РКИ по антиоксидантным добавкам: метаанализ], JAMA (2007). PubMed, ID 17327526
- Oxidative stress-related biomarkers as promising indicators of inflammatory activity in IBD: A meta-analysis [Биомаркеры окислительного стресса как маркеры воспаления при ВЗК], Front Immunol. (2024). PMC, ID 11490685
- Antioxidants: a comprehensive review [Антиоксиданты: современный обзор], Antioxidants (Basel) (2025). PMC, ID 12085410
- Effect of Antioxidant Polyphenol Supplementation on Cardiometabolic Risk Factors: A Meta-Analysis [Влияние полифенолов на кардиометаболические факторы: метаанализ], Nutrients (2024). PubMed, ID 39683599
- Free radicals and their impact on health and antioxidant defense [Свободные радикалы, здоровье и системы антиоксидантной защиты], Acta Biochim. Pol. (2025). Nature, 2025
- Functional and Therapeutic Roles of Plant-Derived Antioxidants: Recent Advances [Функциональные и терапевтические роли антиоксидантов растений: новые данные], Int. J. Mol. Sci. (2025). PMC, ID 12189370
- Potential use of antioxidants for the treatment of chronic inflammatory diseases [Потенциал антиоксидантов для лечения хронических воспалительных заболеваний], Front Pharmacol. (2024). Frontiers, 2024
Материал подготовил:
нутрициолог Дадали чата, химик, исследователь Ю.А. Грачёва