Для кого: Широкая аудитория, нутрициологи, специалисты по превентивной и функциональной медицине.
Тип доказательств: Систематические обзоры и мета-анализы, лонгитюдные когортные исследования, фундаментальные иммунологические исследования, крупномасштабные эпидемиологические наблюдения, клинические испытания по применению микронутриентов, современные вирусологические и биоинформатические исследования.
Дадали Чат
Консультации по нутрициологии на базе знаний профессора Дадали
Получите научно-обоснованные рекомендации в чате, где работают как живые специалисты, так
и интеллектуальный бот, обученный на лекциях профессора Владимира Абдулаевича Дадали
Главное из статьи за 30 секунд
- Аутоиммунный тиреоидит Хашимото (АИТ) — самая частая причина гипотиреоза в странах с нормальным потреблением йода. Иммунная система атакует клетки щитовидной железы, что со временем приводит к снижению выработки гормонов.
- Важную роль в запуске аутоиммунного процесса играют вирусы герпеса (прежде всего вирус Эпштейна–Барр и HHV-6), генетическая предрасположенность, избыток йода, дефицит селена, витамина D, железа и хронический стресс.
- Официальная медицина компенсирует уже сформировавшийся гипотиреоз левотироксином, но не воздействует на первопричины аутоиммунного процесса. Поэтому принципиально важны нутрициологическая коррекция, работа с кишечником, микробиотой, стрессом и токсической нагрузкой.
- Комплексный превентивный подход (микронутриенты, восстановление кишечного барьера, нормализация сна, умеренная физическая активность, снижение вирусной и токсической нагрузки) помогает уменьшать уровень антител, поддерживать функцию железы и снижать риск других аутоиммунных заболеваний.
Что такое аутоиммунный тиреоидит Хашимото
Аутоиммунный тиреоидит Хашимото — это хроническое органоспецифическое аутоиммунное заболевание, при котором иммунная система утрачивает толерантность к тканям щитовидной железы и начинает вырабатывать антитела к тиреопероксидазе (анти-ТПО) и тиреоглобулину (анти-ТГ). Женщины болеют в 8–10 раз чаще мужчин, пик приходится на возраст 30–50 лет.
В ткани железы постепенно формируется лимфоцитарная инфильтрация: Т- и В-лимфоциты, плазматические клетки и макрофаги образуют лимфоидные фолликулы, а нормальные фолликулы разрушаются. Со временем железистая ткань замещается фиброзной, развивается стойкий гипотиреоз.
Высокие титры анти-ТПО и анти-ТГ связаны не только с риском прогрессирования гипотиреоза, но и с выраженностью симптомов — усталости, депрессии, когнитивных нарушений, проблем с кишечником. Поэтому снижение уровня антител — важная цель комплексной коррекции, а не только «красивый анализ».
Классификация аутоиммунного тиреоидита
Первичный аутоиммунный тиреоидит
К первичному АИТ относят несколько клинико-морфологических вариантов:
- Классическая (гипертрофическая) форма — диффузный или узловой зоб с плотной железой и выраженной лимфоцитарной инфильтрацией. Со временем развивается гипотиреоз.
- Фиброзный вариант — преобладает фиброз в пределах капсулы железы, ткань очень плотная, требуется дифференцировать с опухолью.
- IgG4-ассоциированный тиреоидит — инфильтрация IgG4-продуцирующими плазматическими клетками, выраженный фиброз, сочетания с другими IgG4-связанными заболеваниями.
- Ювенильная форма — возникает у детей и подростков, чаще с гиперплазией фолликулов и относительно меньшим фиброзом.
- Хаситоксикоз — транзиторная фаза тиреотоксикоза за счёт разрушения тироцитов и выброса гормонов, затем формируется гипотиреоз.
- Безболевой (в т. ч. послеродовой) тиреоидит — типичная смена фаз: тиреотоксикоз → гипотиреоз → восстановление. Послеродовый вариант встречается у 5–10% женщин в первый год после родов.
Вторичный аутоиммунный тиреоидит
Развивается под влиянием внешних факторов:
- Лекарственно-индуцированный тиреоидит — на фоне интерферона-α, амиодарона, лития, иммунных чек-пойнт-ингибиторов.
- Радиационно-индуцированный тиреоидит — после облучения шеи или радиойодтерапии.
- Атрофический АИТ (идиопатическая микседема) — выраженная атрофия щитовидной железы, которая практически не пальпируется, с тяжёлым гипотиреозом.
Причины и факторы риска
Развитие тиреоидита Хашимото — результат сложного взаимодействия генетики, факторов среды и нарушенной регуляции иммунитета.
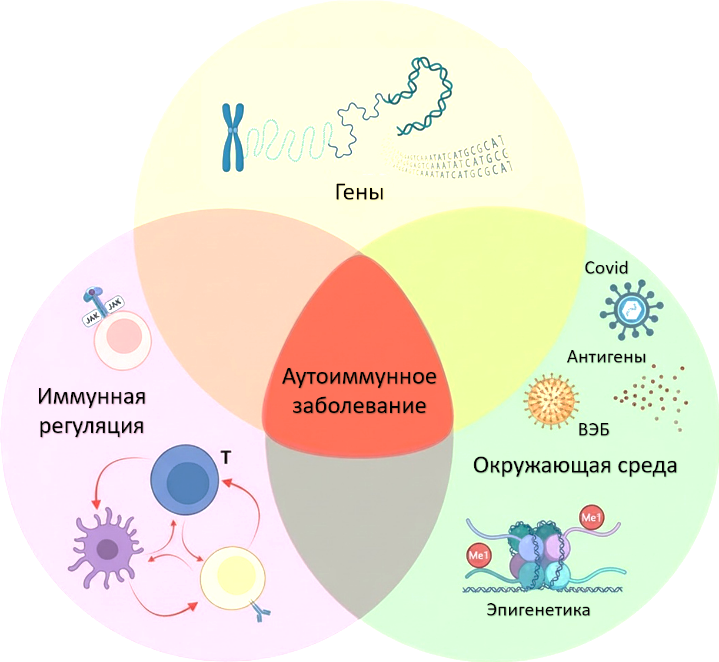
Патогенез аутоиммунного заболевания. Развитие аутоиммунного заболевания возникает при совпадении трех критических факторов: генетической предрасположенности, воздействия фактора окружающей среды и дефектов иммунной регуляции.
Источник: M. Kumar, et al. Front. Immunol., 2025, 16, 1626082. DOI: 10.3389/fimmu.2025.1626082
Генетическая предрасположенность
Семейная агрегация, повышенный риск у родственников первой линии, более высокая конкордантность у монозиготных близнецов. Важную роль играют варианты HLA-DR3, DR4, DR5 и гены вне HLA (CTLA-4, PTPN22, CD40, IL-2RA), влияющие на активацию Т-клеток и поддержание толерантности.
Пол и возраст
Женщины болеют чаще из-за влияния эстрогенов на дифференцировку Т- и В-клеток и наличия двух Х-хромосом с генами иммунного ответа. Риск повышается в периоды гормональных перестроек — после родов, в перименопаузе.
Факторы окружающей среды
- Избыток йода усиливает образование активных форм кислорода при синтезе гормонов и изменяет структуру тиреоглобулина, делая его более «заметным» для иммунной системы.
Важно: Не следует путать корректное использование йода для профилактики дефицита и бесконтрольный прием высоких доз йодсодержащих препаратов или систематическое употребление очень больших количеств богатых йодом продуктов (например, отдельных видов морских водорослей, как это иногда бывает в традиционном рационе в Японии).
- Дефицит селена ослабляет защиту от окислительного стресса в щитовидной железе и нарушает работу дейодиназ.
- Дефицит витамина D нарушает баланс Th17/Treg и способствует гиперреактивности иммунитета.
- Дефицит железа ухудшает работу тиреопероксидазы и снижает синтез гормонов даже при достаточном йоде.
- Хронический стресс через ось гипоталамус–гипофиз–надпочечники смещает иммунный ответ в сторону провоспалительных цитокинов.
- Токсические факторы (пестициды, тяжёлые металлы, растворители) действуют как эндокринные дизрапторы и иммунные раздражители.
Связь вирусов герпеса и болезни Хашимото: новые научные данные
Современные данные всё убедительнее показывают, что вирусы семейства герпеса — значимый фактор, способный запускать или усиливать аутоиммунный процесс у генетически предрасположенных людей.
Вирус Эпштейна–Барр (EBV)
У многих пациентов с Хашимото выявляют повышенные титры EBV-специфических антител и фрагменты вирусной ДНК/РНК в ткани щитовидной железы. В экспериментальных и клинических работах показаны несколько механизмов:
- Молекулярная мимикрия — отдельные белки EBV структурно похожи на фрагменты тиреоглобулина и тиреопероксидазы; иммунная система, распознав вирус, «заодно» атакует схожие эпитопы на тироцитах.
- Активация врождённого иммунитета через TLR-рецепторы и усиление Th1/Th17-ответа.
- Нарушение клиренса инфицированных клеток за счёт вирусного IL-10 (vIL-10) и других иммуномодулирующих белков.
- Повышение экспрессии HLA-II на тироцитах и превращение их в полноценные антиген-презентирующие клетки.
Герпесвирус человека 6 типа (HHV-6)
В биоптатах щитовидной железы пациентов с Хашимото HHV-6 обнаруживают в десятки раз чаще, чем в контроле. Показаны активная репликация вируса в тироцитах, индукция HLA-II, рост числа вирус-специфичных Т-клеток и повышенная цитотоксичность NK-клеток в отношении инфицированных клеток.
Вывод: Тиреоидит Хашимото всё чаще рассматривается как потенциально «вирус-индуцированное» аутоиммунное заболевание: хроническая персистенция герпесвирусов на фоне генетической уязвимости и дефицитов микронутриентов запускает цепочку событий, приводящих к разрушению щитовидной железы.
Читайте также: Вирус Эпштейна–Барр и рассеянный склероз
Симптомы и признаки заболевания
Клиника АИТ развивается медленно, часто годами, поэтому дебют легко пропустить.
Ранняя стадия (эутиреоз – функция щитовидной железы сохранена)
- быстрая утомляемость, особенно к вечеру;
- лёгкий дискомфорт или «комок» в области шеи;
- снижение работоспособности, нестабильное настроение.
Гормоны могут быть ещё в пределах нормы, но антитела уже повышены, УЗИ показывает неоднородную структуру железы.
Субклинический гипотиреоз
ТТГ повышен, свободный Т4 в норме. Появляются:
- набор веса при обычном питании;
- зябкость, непереносимость холода;
- запоры, вздутие;
- сухость кожи, ломкость волос и ногтей;
- нарушения менструального цикла, снижение либидо;
- снижение памяти и концентрации, депрессивные эпизоды.
Манифестный гипотиреоз
ТТГ значительно повышен, свободный Т4 снижен:
- выраженная слабость, «энергетический ноль»;
- значимая прибавка веса, отёчность, микседема;
- брадикардия, повышение холестерина и артериального давления;
- сильная депрессия, заторможенность, замедление речи;
- охриплость голоса, мышечные боли и судороги.
Важно помнить: тяжесть симптомов часто коррелирует с уровнем антител и воспалительных цитокинов, а не только с ТТГ и Т4. Поэтому работа с аутоиммунитетом и воспалением так же важна, как и нормализация гормонов.
Диагностика при тиреоидите Хашимото
Основные инструменты диагностики АИТ:
Лабораторные исследования
- ТТГ — наиболее чувствительный маркёр снижения функции щитовидной железы.
- Свободный Т4 и Т3 — отражают текущий гормональный статус.
- Анти-ТПО и анти-ТГ — главный иммунологический критерий АИТ.
- При необходимости — ферритин, железо, витамин D, селен, липидограмма.
У части пациентов с типичной картиной и УЗИ-признаками АИТ антитела могут быть в норме (серонегативный АИТ).
УЗИ щитовидной железы
- диффузная гипоэхогенность;
- неоднородная структура;
- возможные изменения размеров (увеличение или уменьшение);
- иногда — узлы, требующие дообследования.
Дополнительные методы
Биопсия проводится при подозрении на опухоль или атипичном течении; ЭКГ и липидограмма — для оценки сердечно-сосудистого риска при гипотиреозе.
Диагностика провоцирующих факторов
- Серология на вирусы герпесов
В рамках расширенной диагностики при тиреоидите Хашимото имеет смысл оценивать не только гормоны и антитела, но и возможные триггеры хронического воспаления. Для оценки активности латентных герпесвирусных инфекций (EBV, HHV-6 и др.) используют определение IgG-антител методом ИФА. Повышенные титры в сочетании с клиникой и данными других методов могут указывать на активную или реактивированную инфекцию, усиливающую аутоиммунный процесс.
- Клинический анализ крови
При хронических аутоиммунных процессах, в том числе при АИТ, долго может оставаться в пределах референсных значений: организм стремится сохранить гомеостаз, и изменения выявляются лишь на поздних стадиях или при выраженном воспалении/анемии. Поэтому нормальный ОАК не исключает активный аутоиммунный процесс.
- Оценка нутриентного статуса
Имеет ограничения: концентрации витаминов и минералов в сыворотке отражают в первую очередь то, что циркулирует в крови сейчас, но слабо характеризуют внутриклеточные запасы. Возможна ситуация, когда уровень в крови «нормальный», а внутри клеток уже есть функциональный дефицит. Поэтому результаты нужно интерпретировать в контексте симптомов, рациона, сопутствующих анализов, а при необходимости дополнять функциональными или внутриклеточными тестами.
Лечение аутоиммунного тиреоидита
В официальной медицине аутоиммунный тиреоидит Хашимото считается неизлечимым заболеванием: на сегодняшний день не существует лекарственных препаратов, которые бы позволили остановить или повернуть вспять аутоиммунный процесс, или безопасно отмодулировать иммунитет так, чтобы прекратить разрушение щитовидной железы. Антитела продолжают атаковать и разрушать ткань железы, а всё лечение сводится к компенсации её утраченной функции — то есть лечится уже сформировавшийся гипотиреоз, а не первопричина болезни. Основной метод — заместительная гормональная терапия синтетическим тироксином (Т4), причём полноценная выработка активного Т3 часто остаётся нарушенной, поэтому даже при «нормальных» гормональных показателях качество жизни далеко не всегда полностью восстанавливается.
Современные эпидемиологические данные подтверждают системную проблему с назначением левотироксина. Согласно исследованию Brito et al. (JAMA Internal. Medicine, 2021), в США около 7% населения принимает левотироксин по активному рецепту. При этом анализ показал тревожные тенденции: среди пациентов с полными данными по гормонам, около 60% начинали приём левотироксина при субклиническом гипотиреозе (мягко повышенный ТТГ ≤10 мМЕ/л), а 30% получали препарат при полностью нормальной функции щитовидной железы (нормальные ТТГ и свободный Т4). Авторы исследования прямо констатируют «существенное переиспользование» (overuse) левотироксина, подчеркивая отсутствие доказанной клинической пользы такой терапии для качества жизни, настроения и когнитивных функций при пограничных состояниях.
Ключевая проблема современного подхода: при постановке диагноза тиреоидит Хашимото в рамках традиционной модели консультации часто не хватает времени и ресурсов для комплексной работы с факторами, которые привели к развитию аутоиммунного процесса — вирусными инфекциями, кишечной проницаемосттю, дефицитами микронутриентов, хроническим стрессом и токсической нагрузкой. Между тем, диагноз «тиреоидит Хашимото» не должен быть приговором к пожизненному приему гормонов без попытки воздействия на причины заболевания.
Таким образом, в арсенале официальной эндокринологии отсутствуют эффективные средства для селективного регулирования аутоиммунитета при заболевании Хашимото, и пациенты вынуждены всю жизнь принимать гормоны, которые лишь восполняют последствия разрушения железы, а не устраняют причину болезни. Важно понимать: левотироксин необходим при манифестном гипотиреозе и спасает жизни, но он не восстанавливает иммунную толерантность и не останавливает аутоиммунный процесс. Назначение гормонов — это начало лечения, а не его завершение.
Почему важен превентивный и функциональный подход
Наличие АИТ повышает риск других аутоиммунных заболеваний (целиакия, диабет 1 типа, ревматоидный артрит, аутоиммунный гастрит и др. — всего по данным реестра идентифицировано более 100 видов патологий). Это говорит о системной проблеме иммунной регуляции, а не только о «поломке» одного органа. Поэтому необходимо:
- уменьшать вирусную и воспалительную нагрузку;
- устранять дефициты микронутриентов;
- восстанавливать кишечный барьер и микробиоту;
- нормализовать сон, стресс и токсическую нагрузку.
Парадигма должна измениться: вместо пассивного ожидания полного разрушения щитовидной железы и перехода на пожизненную гормональную терапию, необходимо активно работать с факторами, которые можно изменить с момента постановки диагноза.
Профилактика и восстановление здоровья при аутоиммунном тиреоидите
Раздел отражает авторский опыт и клинические наблюдения команды профессора Дадали за >30 лет работы в области превентивной и функциональной медицины. Представленные подходы являются частью комплексной программы, разрабатываемой индивидуально для каждого человека под наблюдением врача. Эти рекомендации дополняют, но не заменяют стандартную эндокринологическую помощь и назначение левотироксина при наличии показаний.
Цель превентивного подхода — не обещание «чудесного излечения», а замедление прогрессирования, снижение уровня антител и рисков сопутствующих проблем, улучшение качества жизни.
Работа с вирусными триггерами и иммунной модуляцией
Учитывая доказанную роль вирусов герпеса (EBV, HHV-6) в развитии АИТ, ключевое значение приобретает поддержка специфического противовирусного иммунитета. Трансфер-факторы (ТФ) — низкомолекулярные пептиды из молозива и яичного желтка — рассматриваются как мягкие иммуномодуляторы, которые по данным ряда работ могут поддерживать клеточно-опосредованный противовирусный ответ. Исследования показывают, что ТФ стимулируют продукцию IL-2 и IFN-γ (цитокинов Th1-ответа), усиливают пролиферацию специфических иммунных клеток и повышают активность NK-клеток, не вызывая системного воспаления. В контексте аутоиммунного тиреоидита это означает возможность целенаправленно модулировать иммунный ответ против вирусных триггеров, снижая нагрузку на щитовидную железу.
Восстановление кишечной проницаемости и баланса микробиоты
Повышенная проницаемость кишечника и дисбиоз — частые спутники аутоиммунных заболеваний. Для их коррекции применяют:
- нормализацию работы иммунной системы кишечника (см подраздел выше);
- общую нормализацию пищеварения и моторики ЖКТ;
- временное снижение доли потенциально раздражающих продуктов (часть злаков, бобовых, паслёновых, избыток сахара);
- персонализированную работу с глютеном (строгий отказ при целиакии, осторожные временные протоколы при непереносимости);
- увеличение доли клетчатки и ферментированных продуктов;
- пробиотики с бутирато-образующими штаммами;
- восстановление нутриентного баланса (витамины, минералы, аминокислоты, жирные кислоты и т.д.).
Микробиота напрямую влияет на баланс Th17/Treg, состояние кишечного барьера и системное воспаление, поэтому без её коррекции эффективность нутрицевтических программ снижается.
Читайте также: Роль клетчатки для здоровья организма
Физическая активность и лимфоток
Умеренная аэробная нагрузка (ходьба, плавание, йога), упражнения с акцентом на диафрагмальное дыхание, мягкие дыхательные практики и бодифлекс:
- улучшают лимфодренаж и выведение метаболитов;
- поддерживают работу сердечно-сосудистой системы;
- снижают уровень стресса и воспаления.
Важно избегать перегрузок и перетренированности, усиливающих продукцию кортизола и подрывающих иммунный баланс.
Гипертермические процедуры
Сауна, инфракрасная кабина и местные тепловые процедуры (грелка):
- расширяют капилляры, усиливают микроциркуляцию;
- стимулируют потоотделение и частично детоксикацию;
- умеренно активируют иммунитет и снижают воспалительные маркёры при регулярном использовании.
Скипидарные ванны (ванны Залманова) оказывают максимальное капилляро-расширяющее действие. Гипертермия способна умеренно активировать иммунные механизмы и улучшать микроциркуляцию, что может быть полезным элементом комплексного оздоровления при отсутствии противопоказаний.
Оптимизация нутриентного статуса
В целом, организму всегда необходимо полное витаминно-минеральное обеспечение — это основа его нормального функционирования.
Это достигается за счет:
- Сбалансированного и разнообразного питания как основного и приоритетного источника.
- Индивидуальной коррекции добавками тех нутриентов, в которых есть дефицит или повышенная потребность.
Ключевые элементы для щитовидной железы:
- Йод — субстрат для синтеза Т4 и Т3. Важен адекватный, а не «удвоенный» приём; избыток при дефиците селена опасен.
- Тирозин — аминокислота-основа для гормонов, нужен при низком белковом рационе, хроническом стрессе.
- Селен — компонент дейодиназ и антиоксидантных ферментов, защищает железу от АФК, способствует снижению антител.
- Железо — часть тиреопероксидазы; латентный дефицит у женщин крайне распространён.
- Цинк — участвует в синтезе и действии гормонов, регулировании иммунной толерантности.
- Витамины группы B — для метилирования, кроветворения, нервной системы.
- Витамин D — иммунный «дирижёр», влияет на Treg и Th17, дефицит связан с тяжестью АИТ. Важно убедиться в достаточном поступлении витаминов и минералов-кофакторов для превращения витамина D в активную форму – кальцитриол.
- Витамин A — влияет на захват йода и чувствительность рецепторов к гормонам.
Критически важно: принимать йод в отрыве от других нутриентов опасно. При дефиците селена, железа и витаминов группы B высокодозный йод может спровоцировать тиреотоксикоз и усилить аутоиммунный процесс. Оптимальная стратегия — комплексная коррекция дефицитов с учётом анализов.
Читайте также: Латентный дефицит железа у женщин: симптомы, причины, лечение
Сон и стресс
Полноценный сон (7–8 часов) с засыпанием до 22–23 часов:
- обеспечивает пик выработки мелатонина;
- стабилизирует работу оси гипоталамус–гипофиз–щитовидная железа;
- снижает провоспалительную активность иммунной системы.
Хронический недосып усиливает дисбаланс Th1/Th17 и снижает активность Treg, усугубляя аутоиммунный фон. Практики управления стрессом (дыхательные техники, медитация, йога, прогулки) — обязательная часть программы.
Читайте также: Мелатонин при аутоиммунных заболеваниях: мифы и реальность
Снижение токсической нагрузки
Минимизация контакта с:
- пластиком, содержащим бисфенол A и фталаты;
- пестицидами и тяжёлыми металлами;
- агрессивной бытовой химией и растворителями
снижает нагрузку на печень и иммунную систему и уменьшает риск эндокринных нарушений. Простые шаги — фильтры для воды, стеклянная посуда, натуральные моющие средства, выбор менее обработанных продуктов.
Ключевой принцип функциональной медицины: аутоиммунное заболевание — это проблема не органа, а иммунной системы в целом. Устранение триггеров (вирусы, кишечная проницаемость, токсины, дефициты), восстановление регуляторных механизмов и поддержка естественной детоксикации позволяют не просто контролировать симптомы, но восстанавливать здоровье на системном уровне.
Возможные осложнения
Без лечения или при недостаточной коррекции АИТ может привести к:
- устойчивому гипотиреозу с поражением сердца, сосудов, нервной системы, репродуктивной функции;
- микседематозной коме при тяжёлом, декомпенсированном гипотиреозе;
- повышенному риску выявления папиллярного рака щитовидной железы (увеличения смертности при этом не отмечено);
- развитию лимфомы щитовидной железы на фоне длительной лимфоцитарной инфильтрации.
Когда обращаться к врачу
Немедленно запишитесь к эндокринологу, если:
- усталость и зябкость стали постоянными, а вес растёт без очевидных причин;
- появились запоры, сухость кожи, выпадение волос;
- есть нарушения цикла, проблемы с зачатием;
- вы ощущаете дискомфорт или увеличение в области шеи;
- у близких родственников есть АИТ, другие аутоиммунные болезни или заболевания щитовидной железы.
Только комплексное обследование (гормоны, антитела, УЗИ, дополнительные анализы) позволяет поставить диагноз и выстроить грамотную стратегию.
Заключение
Аутоиммунный тиреоидит Хашимото — не приговор и не «сбой одного органа». Это сигнал о том, что иммунная система и множество взаимосвязанных звеньев — кишечник, микробиота, детоксикация, стресс-реакции, нутриентный статус — нуждаются в системной поддержке.
Заместительная гормональная терапия при гипотиреозе жизненно важна, но она не исчерпывает возможностей помощи человеку. Добавляя к ней грамотный превентивный и нутрициологический подход — работу с дефицитами, кишечником, вирусной нагрузкой, сном, стрессом и токсинами — можно:
- снизить аутоантительный и воспалительный фон;
- замедлить разрушение щитовидной железы;
- уменьшить риски сопутствующих аутоиммунных и онкологических заболеваний;
- существенно повысить качество жизни.
Понимание механизмов АИТ и активное участие в собственном оздоровлении превращают диагноз из приговора в стимул к осознанной, научно обоснованной работе со своим организмом.
Статья носит информационный характер. Любые изменения питания, приёма добавок, внедрение гипертермических процедур или физических нагрузок должны проводиться только по согласованию с врачом, особенно при уже назначенной гормональной терапии или наличии других хронических заболеваний.
Источники
- Тиреоидит Хашимото: Эпидемиология, патогенез, клиника и терапия. F. Ragusa, et al. Best Pract. Res. Clin. Endocrinol. Metab., 2019, 33(6), 101367. PubMed, ID: 31812326
- Генетика и эпигенетика аутоиммунных заболеваний щитовидной железы. H.J. Lee, et al. Best Pract. Res. Clin. Endocrinol. Metab., 2023, 37(2), 101661. PubMed, ID: 35459628
- Тиреоидит Хашимото. MSD Manuals Professional Edition, 2024. MSD Manual
- Тиреоидит Хашимото: современные данные об этиологии, диагностике и лечении. J. Klubo-Gwiezdzinska, et al. Pol. Arch. Intern. Med., 2022, 132(3), 16222. PubMed, ID: 35243857
- Распространённость тиреоидита Хашимото: обзор литературы. H. Vargas-Uricoechea, et al. Med Sci (Basel), 2025, 13(2), 43. PubMed, ID: 40265390
- Вирус Эпштейна–Барр при заболеваниях щитовидной железы. Z. Wang, et al. Front. Endocrinol., 2025, 16, 1687214. PubMed, ID: 41229422
- Вирусологические и иммунологические доказательства связи между HHV-6 и тиреоидитом Хашимото. E. Caselli, et al. PLoS Pathog., 2012, 8(10), e1002951. PubMed, ID: 23055929
- Вирусная инфекция и заболевания щитовидной железы: обзор литературы. Y. Li, et al. Front. Microbiol., 2025, 16, 1625179. PubMed, ID: 40584044
- Факторы окружающей среды как триггеры аутоиммунного тиреоидита. C.L. Burek, M.V. Talor. J. Autoimmun., 2009, 33(3–4), 183–189. PubMed, ID: 19818584
- Связь питания и микроэлементов с аутоиммунной патологией щитовидной железы и их влияние на здоровье сердечно-сосудистой системы. M. Mazur, et al. Pathophysiology, 2025, 32(3), 37. PubMed, ID: 40843807
- Влияние множественных факторов питания на риск развития тиреоидита Хашимото. S. Hu, et al. Thyroid, 2017, 27(5), 597–610. PubMed, ID: 28290237
- Применение препаратов селена у пациентов с тиреоидитом Хашимото: систематический обзор и метаанализ. V.V. Huwiler, et al. Thyroid, 2024, 34(3), 295–313. PubMed, ID: 38243784
- Селен и патология щитовидной железы. F. Wang, et al. Front. Endocrinol., 2023, 14, 1133000. PubMed, ID: 37033262
- Методическое письмо N14/231 «Иммунореабилитация при инфекционно-воспалительных и соматических заболеваниях с использованием Трансфер Факторов» от 30 июля 2004 г.
- Дефицит витамина D при тиреоидите Хашимото: механизмы, иммунная модуляция и терапевтические перспективы. W. Sun, et al. Front. Endocrinol., 2025, 16, 1576850. PubMed, ID: 40822954
- Взаимосвязь между дефицитом железа и функцией щитовидной железы: систематический обзор и метаанализ. V. Garofalo, et al. Nutrients, 2023, 15(22), 4790. PubMed, ID: 38004184
- Микробиота кишечника и тиреоидит Хашимото. C. Virili. Rev. Endocr. Metab. Disord., 2018, 19(4), 293–300. PubMed, ID: 30294759
- «Дырявый» кишечник как сигнал опасности для развития аутоиммунных заболеваний. Q. Mu, et al. Front. Immunol., 2017, 8, 598. PubMed, ID: 28588585
- Реакция антител, специфичных к лектинам, с тканями человека: потенциальный вклад в развитие аутоиммунной патологии. A. Vojdani, et al. J. Immunol. Res., 2020, 2020, 1438957. PubMed, ID: 32104714
- Трансфер-факторы как иммуномодулятор: обзор. M. Krishnaveni. Drug Invent. Today., 2013, 5(2), 153–156. DOI: 10.1016/j.dit.2013.04.002
- Эффективность комбинированной терапии фотобиомодуляции с добавками по сравнению с только добавками в восстановлении гомеостаза щитовидной железы при тиреоидите Хашимото: параллельное клиническое исследование с 6-месячным наблюдением. V. Berisha-Muharremi, et al. J. Pers. Med., 2023, 13(8), 1274. PubMed, ID: 37623524